Strumentazione IN-CNR
 |
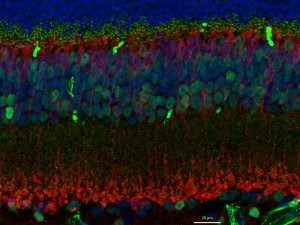
MICROSCOPIO A DUE FOTONI – La microscopia a due fotoni è attualmente la tecnica di elezione per l’imaging di cellule e tessuti viventi. La microscopia a due fotoni utilizza un laser per eccitare molecole fluorescenti in un campione, e opportuni rivelatori per misurare la luce emessa. Tuttavia, a differenza dei laser utilizzati per microscopia confocale, che forniscono singoli fotoni di luce visibile, i laser usati in microscopia a due fotoni eccitano il campione sfruttando l’assorbimento simultaneo di due fotoni nell’infrarosso (800-900 nm). Questo porta a due vantaggi. Le lunghezze d’onda utilizzate per la microscopia a due fotoni sono meno tossiche per le cellule e penetrano più profondamente nei tessuti rispetto a quelli utilizzati in microscopia confocale. Inoltre, la necessità dell’assorbimento simultaneo di due fotoni implica che l’eccitazione del fluoroforo viene realizzata solo in prossimità del piano focale dove la luce laser è più concentrata. Questo riduce l’emissione di luce fuori fuoco che potrebbe rendere l’immagine sfocata e di difficile interpretazione. Nel nostro laboratorio, il microscopio a due fotoni viene utilizzato per l’imaging longitudinale delle spine dendritiche neuronali (vedi foto). |
 |
NEUROLUCIDA – Il sistema Neurolucida è il gold standard per l’analisi morfometrica di campioni istologici, in particolare per la ricostruzione 3D di alberi e strutture neuronali. Si compone di un microscopio Zeiss Axiophot (per luce trasmessa e fluorescenza) dotato di pianetto motorizzato e un set completo di obiettivi (5x, 10x, 20x, 40x, 100x). Le immagini sono catturate tramite una telecamera e processate mediante apposito software (Microbrightfield Inc.) che permette di rilevare spine e sinapsi in un ambiente 3-dimensionale ed ottenere dati affidabili circa le dimensioni, la forma e la complessità dei neuroni. |
 |
MICROSCOPIO CONFOCALE LEICA TCS – Si tratta di un microscopio confocale spettrale utilizzato dai nostri ricercatori per l’esame di preparati vivi o fissati che richiedano imaging ad alta risoluzione. Le principali applicazioni comprendono: lo studio delle caratteristiche morfologiche di singole popolazioni cellulari in diverse condizioni sperimentali, gli effetti di sostanze sull’organizzazione cellulare, l’esame di campioni patologici per studiare tessuti e anomalie sinaptiche, la funzione di organelli intracellulari, la distribuzione intracellulare ed il movimento di singole molecole.
Le caratteristiche principali di questo microscopio sono: Microscopio: Microscopio diritto Leica DM6000B per l’osservazione di campioni istologici; Microscopio invertito DM Ire 2 dotato di cameretta con controllo digitale della temperatura e concentrazione di CO2 / Ossigeno per l’osservazione delle cellule viventi. Entrambi i microscopi sono dotati di epifluorescenza con filtri DAPI, FITC e TRITC. La testa di scansione confocale può essere spostata dal microscopio diritto al microscopio invertito. |
 |
|
|
|
MICROSCOPIO CONFOCALE ZEISS LSM900 CON AIRYSCAN 2. E’ un sistema altamente integrato ed autocontenuto nel quale la testata confocale è montata sulla porta laterale di un microscopio Zeiss Axio Observer rovesciato. Lo stand del microscopio è interamente automatizzato e comprende un tavolino motorizzato sui tre assi, ottica DIC e telecamera LED. La testa confocale è dotata di scanner lineari galvanometrici con pinhole modificabili in continuo, fotomoltiplicatori PMT, un detector GaAsP ad alta sensibilità e un detector Airyscan 2. La nuova tecnologia Airyscan consente una risoluzione di 1.7 volte al di là del limite teorico (super risoluzione).Il microscopio è dotato di 4 laser allo stato solido con linee di emissione a 405 nm, 488 nm, 561 nm e 640 nm ed è controllato dal software ZEN 3.0. Questo programma comprende numerose opzioni, tra cui routine per visualizzazione multicanale, moduli per analisi di immagine quantitativa, software specifici per studi di colocalizzazione e un sistema di riconoscimento automatico dei parametri di acquisizione di immagini salvate in formato proprietario. Lo strumento è versatile e adatto a studi in vitro ed ex vivo. |

|
MICROSCOPIO APOTOME ZEISS – Questo sistema è in grado di creare sezioni ottiche da campioni fluorescenti rimuovendo il segnale fuori fuoco per mezzo di una apposita griglia. Il risultato è un’immagine con elevato contrasto e una risoluzione simile a quella del confocale. I vantaggi di questo strumento includono l’alta velocità di funzionamento, la possibilità di eccitare più fluorofori con una singola sorgente luminosa (tipicamente una lampada HBO convenzionale). La scelta del set di filtri è molto semplice e è possibile lavorare con i classici DAPI, FITC, TRITC ed il rosso lontano (Cy5) o con coloranti vitali quali GFP. Il sistema è altamente automatizzato, con i tre assi del pianetto sotto controllo elettronico. Le singole sezioni ottiche possono essere combinate per il rendering 3D di campioni spessi.
Il microscopio è dotato di una serie completa di obiettivi ad alta apertura numerica e diversi softwares per l’acquisizione delle immagini. Particolarmente utile è un software Panorama per l’imaging di grandi campioni attraverso il montaggio automatico di più immagini |
 |
MICROSCOPIO ELETTRONICO A TRASMISSIONE JEOL – Quando il potere risolutivo del microscopio ottico non è sufficiente, è possibile studiare singole molecole o organelli subcellulari tramite microscopia elettronica (EM) a trasmissione. Il nostro Jeol 1200 EM EXII permette l’analisi di campioni inclusi in resine specifiche, e sezionati con un ultramicrotomo Leica V Ultratome e lame di diamante.
Il nostro apparecchio presenta una tensione di accelerazione massima di 120 KV e un elevato contrasto adatto per applicazioni biologiche. Il sistema è stato costantemente aggiornato, con la recente acquisizione di una telecamera CCD Veleta collocata su un lato della colonna microscopio. La fotocamera, facile da usare e con elevata sensibilità e qualità delle immagini, è molto veloce ed efficiente.
|